- AMINO-ACIDES
- AMINO-ACIDESLes vingt acides aminés étudiés dans cet article sont les unités structurales de la plupart des protéines. On les a nommés acides aminés, car ce sont des substances organisées autour d’un atome de carbone portant: la fonction acide-COOH, la fonction basique amine-NH2 (d’où le nom acide aminé ), un atome d’hydrogène et un radical R qui distingue et caractérise les vingt acides aminés:
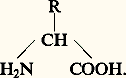 Les acides aminés ont en commun la partie encadrée; donc les acides aminés ont des propriétés communes mais se différencient par leur radical. De plus, cette organisation autour du carbone est non plane comme sur le schéma, mais développée dans l’espace de telle sorte qu’il peut exister deux formes qui sont symétriques donc non superposables (comme un objet et son image dans un miroir). Sauf en certains cas, dans les protéines, ne figure qu’un seul type de configuration dénommé L.Les radicaux R ont des propriétés qui distinguent nettement les acides aminés les uns des autres en leur conférant des propriétés physico-chimiques et réactives particulières. Ainsi la capacité d’établir entre eux, ou avec les éléments du milieu où ils se trouvent en solution, différents types de liaisons fortes ou faibles , c’est-à-dire difficilement ou facilement rompues.Parmi les propriétés communes, l’une est fondamentale: la fonction acide d’un acide aminé peut réagir (dans certaines conditions) avec l’amine d’un autre acide aminé pour former une liaison peptidique:
Les acides aminés ont en commun la partie encadrée; donc les acides aminés ont des propriétés communes mais se différencient par leur radical. De plus, cette organisation autour du carbone est non plane comme sur le schéma, mais développée dans l’espace de telle sorte qu’il peut exister deux formes qui sont symétriques donc non superposables (comme un objet et son image dans un miroir). Sauf en certains cas, dans les protéines, ne figure qu’un seul type de configuration dénommé L.Les radicaux R ont des propriétés qui distinguent nettement les acides aminés les uns des autres en leur conférant des propriétés physico-chimiques et réactives particulières. Ainsi la capacité d’établir entre eux, ou avec les éléments du milieu où ils se trouvent en solution, différents types de liaisons fortes ou faibles , c’est-à-dire difficilement ou facilement rompues.Parmi les propriétés communes, l’une est fondamentale: la fonction acide d’un acide aminé peut réagir (dans certaines conditions) avec l’amine d’un autre acide aminé pour former une liaison peptidique: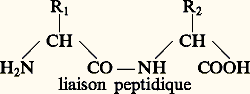 On conçoit que des acides aminés puissent s’ajouter les uns aux autres pour former une chaîne peptidique.La formation des chaînes polypeptidiques représente une contrainte d’organisation qui fait apparaître des propriétés de comportement du polypeptide que les acides aminés libres en solution ne présenteraient pas ou ne présenteraient que difficilement. En particulier, il peut s’établir des liaisons très nombreuses entre les liaisons peptidiques elles-mêmes et entre les radicaux, qui permettent au polypeptide d’acquérir ce que l’on appelle une conformation spatiale. On conçoit que si les différents acides aminés sont placés dans un ordre rigoureusement défini, à cet ordre correspondra un certain nombre de possibilités de liaisons et qu’à des conditions déterminées correspondra une conformation possible. Cette conformation ne sera pas rigide et pourra varier de façon discrète en fonction des conditions du milieu par établissement ou rupture de liaisons faibles.Les protéines sont, en définitive, des molécules constituées d’une ou plusieurs chaînes polypeptidiques, comprenant de quelques centaines à plusieurs milliers d’unités d’acides aminés, l’ordre (ou séquence) dans ces chaînes étant rigoureusement déterminé.Des groupes R, très éloignés les uns des autres dans la chaîne ou les chaînes, peuvent être rapprochés du fait de la structure spatiale et constituer un centre réactif particulier que des acides aminés libres ne pourraient former.Il résulte de la conformation de ces molécules et de sa plasticité, de la réactivité des radicaux un grand nombre de fonctions biologiques dans l’organisation, la structuration et la catalyse sans laquelle, pratiquement, aucune réaction ne se produirait dans les cellules.Les acides aminés sont synthétisés dans les cellules par des suites de réactions ou «voies de synthèse». Les cellules ne sont pas toujours en mesure de synthétiser tous les acides aminés. Dans ce cas, elles doivent trouver dans leur milieu ceux qu’elles ne peuvent synthétiser; ils sont dénommés indispensables; il y en a par exemple une dizaine pour les mammifères.Enfin, les acides aminés sont aussi précurseurs pour la synthèse d’autres molécules, par exemple le glycocolle pour les bases puriques. Dans nombre de ces synthèses, la molécule de l’acide aminé précurseur subit des transformations et souvent certaines parties seulement sont intégrées dans la molécule synthétisée.Les cellules dégradent aussi les acides aminés, dont les produits de dégradation empruntent différentes voies. Certaines de ces voies conduisent à la synthèse d’autres molécules, d’autres conduisent à la production d’énergie utilisable par la cellule.Propriétés physiquesLes acides aminés se présentent sous forme de solides blancs, cristallisés, solubles dans l’eau où ils donnent des solutions incolores. Les moins solubles sont la cystine, la tyrosine, la leucine.IonisationLes amino-acides possèdent au moins deux groupes ionisables: la fonction carboxylique et la fonction amine. Lorsque ces groupes fonctionnels sont simultanément dissociés, les amino-acides sont sous la forme d’ions mixtes R 漣CH 漣NH+3, C- (zwitterions). À bas pH, l’amino-acide est considéré comme un diacide qui perd un premier proton, en se transformant en ion mixte si le pH s’élève. Un deuxième proton est ensuite libéré quand l’ion mixte se transforme en anion. Selon la convention de Brønsted, les équilibres d’ionisation sont donnés par les réactions 1.Il leur correspond des constantes de dissociation K1 et K2 (cf. fig. 1).Le pH auquel la molécule possède une charge nette nulle est désigné par le terme de «pH isoélectrique»; sa valeur est donnée par la formule:
On conçoit que des acides aminés puissent s’ajouter les uns aux autres pour former une chaîne peptidique.La formation des chaînes polypeptidiques représente une contrainte d’organisation qui fait apparaître des propriétés de comportement du polypeptide que les acides aminés libres en solution ne présenteraient pas ou ne présenteraient que difficilement. En particulier, il peut s’établir des liaisons très nombreuses entre les liaisons peptidiques elles-mêmes et entre les radicaux, qui permettent au polypeptide d’acquérir ce que l’on appelle une conformation spatiale. On conçoit que si les différents acides aminés sont placés dans un ordre rigoureusement défini, à cet ordre correspondra un certain nombre de possibilités de liaisons et qu’à des conditions déterminées correspondra une conformation possible. Cette conformation ne sera pas rigide et pourra varier de façon discrète en fonction des conditions du milieu par établissement ou rupture de liaisons faibles.Les protéines sont, en définitive, des molécules constituées d’une ou plusieurs chaînes polypeptidiques, comprenant de quelques centaines à plusieurs milliers d’unités d’acides aminés, l’ordre (ou séquence) dans ces chaînes étant rigoureusement déterminé.Des groupes R, très éloignés les uns des autres dans la chaîne ou les chaînes, peuvent être rapprochés du fait de la structure spatiale et constituer un centre réactif particulier que des acides aminés libres ne pourraient former.Il résulte de la conformation de ces molécules et de sa plasticité, de la réactivité des radicaux un grand nombre de fonctions biologiques dans l’organisation, la structuration et la catalyse sans laquelle, pratiquement, aucune réaction ne se produirait dans les cellules.Les acides aminés sont synthétisés dans les cellules par des suites de réactions ou «voies de synthèse». Les cellules ne sont pas toujours en mesure de synthétiser tous les acides aminés. Dans ce cas, elles doivent trouver dans leur milieu ceux qu’elles ne peuvent synthétiser; ils sont dénommés indispensables; il y en a par exemple une dizaine pour les mammifères.Enfin, les acides aminés sont aussi précurseurs pour la synthèse d’autres molécules, par exemple le glycocolle pour les bases puriques. Dans nombre de ces synthèses, la molécule de l’acide aminé précurseur subit des transformations et souvent certaines parties seulement sont intégrées dans la molécule synthétisée.Les cellules dégradent aussi les acides aminés, dont les produits de dégradation empruntent différentes voies. Certaines de ces voies conduisent à la synthèse d’autres molécules, d’autres conduisent à la production d’énergie utilisable par la cellule.Propriétés physiquesLes acides aminés se présentent sous forme de solides blancs, cristallisés, solubles dans l’eau où ils donnent des solutions incolores. Les moins solubles sont la cystine, la tyrosine, la leucine.IonisationLes amino-acides possèdent au moins deux groupes ionisables: la fonction carboxylique et la fonction amine. Lorsque ces groupes fonctionnels sont simultanément dissociés, les amino-acides sont sous la forme d’ions mixtes R 漣CH 漣NH+3, C- (zwitterions). À bas pH, l’amino-acide est considéré comme un diacide qui perd un premier proton, en se transformant en ion mixte si le pH s’élève. Un deuxième proton est ensuite libéré quand l’ion mixte se transforme en anion. Selon la convention de Brønsted, les équilibres d’ionisation sont donnés par les réactions 1.Il leur correspond des constantes de dissociation K1 et K2 (cf. fig. 1).Le pH auquel la molécule possède une charge nette nulle est désigné par le terme de «pH isoélectrique»; sa valeur est donnée par la formule: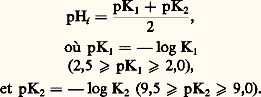 À ce «point isoélectrique», l’amino-acide ne migre pas en électrophorèse et sa solubilité est minimale.Absorption ultravioletteLes amino-acides n’absorbent pas les rayonnements dans la partie visible du spectre, mais possèdent un pouvoir d’absorption considérable avant 230 nm. De plus, certains amino-acides absorbent entre 250 et 300 nm, grâce à la présence, dans leur radical R, de chromophores spéciaux: indole pour le tryptophane, benzène pour la phénylalanine et la tyrosine, pont disulfure pour la cystine.Stéréo-isomérieTous les acides aminés naturels, sauf le glycocolle, possèdent un carbone asymétrique. C’est ce carbone qui porte la fonction amine, la fonction carboxylique, un atome d’hydrogène et le radical R. Tous, sauf le glycocolle, sont donc actifs sur la lumière polarisée. L’alanine se présente ainsi sous deux formes, L ou D-alanine, qui sont deux isomères optiques ou énantiomorphes. La forme D possède une structure spatiale analogue à celle du D-glycéraldéhyde qui est le corps de référence, tandis que la forme L correspond au L-glycéraldéhyde. La terminologie D-L ne correspond pas au pouvoir rotatoire de la substance qui doit être indiqué par un signe + ou 漣 suivant son caractère dextrogyre ou lévogyre: exemple L (+) isoleucine, L (face=F0019 漣) leucine.Lorsque l’acide aminé possède deux carbones asymétriques (ex.: thréonine, isoleucine, hydroxylysine, hydroxyproline), on retrouve quatre isomères: l’isomère naturel porte simplement le préfixe L (ex.: L-isoleucine), l’énantiomorphe sera la D-isoleucine; les deux autres isomères seront la D et la L-allo-isoleucine.Tous les amino-acides naturels sont de la série L, quelques amino-acides de la série D ont été retrouvés dans les micro-organismes et dans des protéines de mammifères non soumises à renouvellement.Propriétés chimiquesLes propriétés chimiques sont dues à l’existence d’un groupe carboxyle, d’un groupe amine, à la coexistence de ces deux groupes et à la structure du radical R.Réactions du groupe carboxyleDeux réactions sont particulièrement importantes: l’estérification et la décarboxylation.L’estérification des amino-acides permet leur transformation en dérivés volatils au cours de l’analyse par chromatographie en phase gazeuse. Les esters n -butyliques sont les plus utilisés. Cependant, l’insolubilité de certains amino-acides (cystine, lysine, histidine) dans l’alcool n -butylique conduit à réaliser l’estérification avec du méthanol absolu saturé par de l’acide chlorhydrique anhydre, dans lequel tous les acides aminés sont solubles. Ensuite, on convertit quantitativement les dérivés obtenus en esters n -butyliques par inter-estérification.Les esters des amino-acides sont réduits en amino-alcools par l’hydrure double de lithium et de bore; cette réaction a été utilisée pour la détermination des résidus C-terminaux des peptides et des protéines.La décarboxylation des amino-acides est aisément obtenue par chauffage dans un solvant inerte; elle conduit à la formation d’amines, dont certaines jouent un rôle biologique essentiel (histamine, tyramine).Réactions du groupe amineDe très nombreuses réactions utilisant la réactivité de la fonction amine ont été décrites: elles sont particulièrement utilisées pour la détermination des groupements NH2 terminaux des peptides ou protéines.La détermination des NH2 terminaux des protéines utilise une N-arylation ou l’action de l’isothiocyanate de phényle.a ) Le dinitro-2, 4 fluorobenzène se condense à froid; en milieu alcalin, avec la fonction amine des amino-acides pour donner un dérivé dinitrophénylé ou dérivé DNP (réaction 2); elle est peu utilisée.b ) L’isothiocyanate de phényle, en milieu basique, se combine à la fonction NH2 des amino-acides (réaction 3).En milieu acide, le produit formé se condense en phénylthiohydantoïne ou PTH amino-acide thiohydantoïne (formule 4).Cette technique d’Edmann permet de préciser la nature du premier amino-acide d’une protéine. Seul l’amino-acide N terminal est détaché, laissant intact le reste du peptide qui pourra donc être utilisé pour une nouvelle analyse. Cette méthode dite récurrente est à la base de la technique automatique de séquençage des peptides, méthode d’Edman utilisant un séquenceur.c ) D’autres réactifs (chlorure de dansyl, chlorure de dabsyl) sont utilisés pour l’analyse de l’amino-acide N terminal des protéines; les produits obtenus étant fluorescents, la méthode est très sensible.Réactions du carboxyle et de l’amine en size=4見Les amino-acides peuvent chélater l’ion cuivrique pour former des complexes comportant une ou deux molécules d’amino-acides par atome de cuivre; en même temps apparaît une coloration bleu intense utilisable pour les dosages colorimétriques.Les amino-acides en solution aqueuse bouillante réagissent avec la ninhydrine (hydrate de tricétohydrindène) pour donner, à pH acide, une coloration pourpre ou pourpre de Ruhemann, sauf avec la proline et l’hydroxy-proline qui fournissent une coloration jaune. L’amino-acide est décomposé en gaz carbonique ammoniac et aldéhyde inférieur R 漣CHO. Cette coloration est utilisée dans les dosages des amino-acides après chromatographie sur colonne.Une très importante propriété des deux fonctions est la formation de liaison amide; lorsque celle-ci s’effectue entre deux amino-acides, on parle de liaison peptidique ou liaison 漣CO 漣NH. Elle est peptidoïde si la liaison s’effectue entre un acide- 見-aminé et un amino-acide non 見-aminé; pseudo-peptidique lorsqu’elle se produit entre un acide 見-aminé et un corps quelconque.Réaction du radical RChaque amino-acide possède une réactivité propre due à son radical R, déterminant ainsi les différents tests colorés spécifiques pour l’identification des divers amino-acides ou certaines propriétés particulières comme l’halogénation de la tyrosine et la formation du pont disulfure entre deux molécules de cystéine.Analyse des amino-acidesL’analyse des mélanges d’amino-acides fournis par l’hydrolyse des protéines ou peptides est réalisée à l’aide de techniques permettant la séparation et le dosage soit d’un seul acide aminé, soit de tous les amino-acides.DosageL’oxydation par l’acide périodique permet de doser spécifiquement les amino-acides hydroxylés (sérine, thréonine, hydroxylysine) par dosage de l’aldéhyde formé. Des réactions colorées permettent de réaliser des dosages colorimétriques de certains amino-acides (arginine, histidine, tyrosine, tryptophanne). Des méthodes enzymatiques permettent de réaliser des dosages spécifiques de plusieurs acides aminés (acide glutamique, alanine, arginine, etc.). La plupart des amino-acides étant des facteurs de croissance pour certains micro-organismes, il est presque toujours possible de doser ces amino-acides par leur action sur le développement microbien qui, dans certaines limites, est proportionnel à la concentration en amino-acide du milieu de culture (méthode de Guthrie).L’addition d’un amino-acide radioactif à un mélange d’amino-acides permet de calculer le rendement d’opérations destinées à purifier l’amino-acide choisi: après dosage de l’amino-acide purifié, on peut calculer simplement la concentration préexistante de l’amino-acide non radioactif (technique de dilution isotopique).SéparationC’est la technique la plus utilisée. La méthode qualitative est la chromatographie sur papier ou support solide, uni- ou bidimensionnelle, avec repérage des taches par réactions colorées. On obtient des résultats quantitatifs avec le fractionnement par chromatographie sur résines cationiques suivi de dosages colorimétriques des éluats, par chromatographie en phase gazeuse après transformation des amino-acides en esters n- butyliques par chromatographie sur support hydrophobe des acides aminés préalablement transformé en PTH amino-acides (fig. 2). Ces trois dernières techniques sont automatisées.Propriétés biochimiquesLes processus généraux de dégradation et de synthèse, intéressant la fonction 見-amino-acide proprement dite, peuvent être séparés en désamination, décarboxylation, transamination. Au cours du métabolisme, les groupements NH2 libérés seront utilisés dans l’uréogenèse et l’ammoniogenèse. La variabilité du radical R des amino-acides entraîne par ailleurs une diversité des réactions propres à chaque amino-acide (cf. EXCRÉTION, physiologie animale).Désamination oxydativeLa désamination des acides- 見-aminés est pratiquement toujours effectuée par oxydation avec formation d’acide 見-cétonique et d’ammoniac suivant la réaction simplifiée 5.La nécessité d’un apport d’oxygène a été démontrée: un atome d’oxygène est consommé par molécule d’amino-acide oxydé, et la quantité d’ammoniac libérée est équi-moléculaire de celle de l’acide- 見-cétonique formé.La vitesse de désamination est curieusement plus grande avec les amino-acides de la série D (non naturelle) qu’avec ceux de la série L (naturelle).On a isolé, dans le foie et le rein de mammifères, quatre amino-acide-oxydases principales:La D-amino-acide-oxydase: la première isolée et la plus abondante; son groupement prosthétique est la flavine-adénine-dinucléotide (FAD). La spécificité de l’enzyme varie suivant l’origine (espèce, organe); presque tous les D-amino-acides sont désaminés, mais les L-amino-acides le sont également quoique à un taux très faible. Cet enzyme peut cependant être utilisé pour détruire électivement les isomères D d’un amino-acide sous forme racémique.La L-amino-acide-oxydase rénale ou hépatique possède comme groupement prosthétique la flavine mono-nucléotide (FMN). Elle désamine les L-acides mono-amines mono-carboxyliques à l’exception des amino-acides hydroxylés. Elle est très peu active in vitro. L’enzyme isolé du venin de serpent se révèle très actif et son groupement prosthétique est le FAD.La glycocolle-oxydase: sa structure est proche de celle de la D-amino-acide-oxydase, et l’identité de ces deux enzymes est discutée. Elle agit sur le glycocolle ou le N-méthylglycocolle, mais à pH élevé et à forte concentration de substrat, ce qui pose le problème de son rôle biologique.La L-glutamique déshydrogénase (obtenue à l’état cristallisé): c’est une protéine de poids moléculaire 250 000 formée de quatre sous-unités reliées entre elles par quatre atomes de zinc. Son coenzyme est le NAD (nicotinamide-adénine-dinucléotide) ou le NADP.Sa distribution tissulaire est très large. Elle assure la désamination de l’acide-L-glutamique en acide- 見-cétoglutarique (réaction 6).Sa spécificité est étroite et son importance métabolique considérable. Dans certains cas, la désamination peut être le fait de réactions spécifiques non oxydatives:– départ de SH2 avec la cystéine désulfhydrase;– départ de H2O avec la thréonine-désaminase;– désamination désaturante de l’histidine.DécarboxylationC’est un processus général des tissus animaux et végétaux et des micro-organismes. Elle s’effectue suivant la réaction 7.Plusieurs des enzymes responsables ont été cristallisés; ils admettent le pyridoxal-5 phosphate pour coenzyme (tabl. 2).L’aromatique L amino-acide-décarboxylase (tabl. 3) permet la décarboxylation de la 3,4-dihydroxy-phénylalanine (DOPA) en dopamine, de l’hydroxy-5 tryptophane en hydroxy-5 tryptamine (ou sérotonine), de la phénylalanine en phényléthylamine, de la tyrosine en tyramine, du tryptophane en tryptamine, de l’histidine en histamine. La plupart de ces substances jouent un grand rôle biologique: histamine dans le choc anaphylactique, dopamine comme précurseur de la noradrénaline, sérotonine dans le métabolisme cérébral.D’autres activités décarboxylasiques ont été retrouvées: acide cystéique-décarboxylase dans le foie, la rate, le cerveau, transformant l’acide cystéique en taurine; acide glutamique-décarboxylase dans le cerveau, transformant l’acide glutamique en acide 塚-amino-butyrique (ou GABA), ornithine décarboxylase transformant l’ornithine en putrescine précurseur des polyamines.Des décarboxylases bactériennes attaquent les acides aminés basiques libérant agmatine, putrescine, cadavérine à partir de l’arginine, ornithine, lysine: ces substances toxiques que l’on désignait sous le terme de ptomaïnes se forment lors de putréfactions intestinales excessives.Les amines formées par décarboxylation sont dégradées par un processus de désamination oxydative grâce à une mono-amine-oxydase (MAO) ou une diaminoxydase avec formation d’ammoniac et d’aldéhyde possédant un carbone de moins que l’amino-acide initial. La MAO est très largement répandue dans l’organisme: elle intervient dans le métabolisme cérébral des catécholamines et de la sérotonine. La diaminoxydase ou histaminase agit sur les diamines ou les amines possédant un second groupe basique (histamine, agmatine) et sur les polyamines; elle est inhibée par les mono-amines.TransaminationC’est l’ensemble des mécanismes par lesquels un amino-acide peut transférer sa fonction amine à un acide 見-cétonique. Les enzymes responsables portent le nom de transaminases ou aminotransférases; leur coenzyme est là encore le phosphate de pyridoxal qui passe intermédiairement par l’état de phosphate de pyridoxamine, selon le mécanisme que schématise le tableau 4.Les voies qui paraissent les plus importantes impliquent la présence du système acide glutamique-acide 見-cétoglutarique; les enzymes responsables ont été isolés et purifiés:acide glutamique + acide pyruvique燎 acide 見-cétoglutarique + alanine ;acide glutamique + acide oxalo-acétique燎 acide 見-cétoglutarique + acide aspartique.La réaction acide aspartique + acide pyruvique 燎 acide oxalo-acétique + alanine ne serait que le résultat d’un couplage des deux réactions précédentes.D’autres amino-acides peuvent aussi subir ces transaminations: les plus actifs sont la valine, la leucine et l’isoleucine; les moins actifs l’histidine et la lysine.D’autres types de transaminations ont été plus récemment décrits:燎 Transamination en 諸:ac. 塚-aminobutyrique + ac. 見-cétoglutarique 燎 semi-aldéhyde succinique + ac. L-glutamique;L-ornithine + acide 見-cétonique燎 semi-aldéhyde L-glutamique + ac. 見-aminé.燎 Transamination à partir d’amides (glutamine ou asparagine):L-glutamine + acide 見-cétonique燎 ac. 見-cétoglutaramique + ac. 見-aminé.L’acide 見-cétoglutaramique est scindé en acide 見-cétoglutarique et ammoniac par une 諸-amidase.Il existe un contraste entre la faible activité des L-amino-acides oxydases (à l’exception de la L-glutamique déshydrogénase) et l’importance des mécanismes de transamination: ce fait plaide en faveur de la prédominance de ceux-ci dans les synthèses et les dégradations des amino-acides. Pour Braunstein, les amino-acides subissent, pour la plupart, une désamination indirecte grâce à la transamination: le groupement NH2 de l’amino-acide est donc d’abord transféré sur l’acide 見-cétoglutarique, et l’acide glutamique ainsi formé est ensuite désaminé par sa déshydrogénase spécifique. Cette conception, vérifiée grâce à l’utilisation d’azote lourd, permet d’établir une classification des amino-acides en deux groupes. Le premier groupe comprend les amino-acides qui ne peuvent être synthétisés dans l’organisme que par transamination ou amination réductrice des acides 見-cétoniques ou des acides hydroxylés correspondants. Ceux-ci n’étant pas des produits normaux du métabolisme intermédiaire des glucides ou des lipides, les réactions se limitent à des échanges du groupement NH2 sans qu’il y ait vraiment de synthèse de novo de ces amino-acides: il en résulte que ceux-ci sont indispensables, c’est-à-dire qu’ils doivent obligatoirement être présents dans la ration alimentaire (tryptophane, phénylalanine, méthionine, valine, leucine, isoleucine).Le second groupe est formé par les amino-acides dont le métabolisme particulier est incompatible avec une synthèse, à partir des acides cétoniques ou hydroxylés correspondants: autrement dit, leur transamination et leur désamination ne sont pas réversibles; suivant les cas, ou bien ils doivent être apportés par l’alimentation et figurent alors dans les amino-acides indispensables (exemples: lysine et thréonine), ou bien leur synthèse s’opérera dans l’organisme, à partir d’autres acides aminés sans échange de NH2, par des réactions de conversion (exemples: glycocolle, cystéine).Propriétés biologiquesPénétration des amino-acides dans la celluleLa constitution par les cellules d’un pool d’amino-acides à fortes concentrations est en rapport avec leur métabolisme, et notamment avec leurs propriétés de synthèse protéique. Les amino-acides pénètrent dans les cellules par simple diffusion, mais aussi grâce à un processus actif qui permet leur accumulation dans la cellule à l’encontre du gradient de concentration. Ce dernier mécanisme consomme de l’énergie; il est plus actif vis-à-vis des formes L naturelles que vis-à-vis des formes D. Les études cinétiques ont montré l’existence de relations de type michaélien entre la concentration intérieure et extérieure de l’amino-acide ainsi que l’existence de phénomènes de compétition entre divers amino-acides.Dans les cellules de la muqueuse intestinale . Les poisons cellulaires (cyanure) ou les découplants des oxydations phosphorylantes (dinitro-2, phénol) sont inhibiteurs, ce qui confirme les besoins énergétiques du système actif. On a également démontré l’importance du phosphate de pyridoxal, grâce à l’inhibition provoquée par ses analogues structuraux. Le transport des amino-acides est indépendant de celui du glucose, comme en témoignent l’absence de compétition entre les deux systèmes et l’absence d’inhibition par un produit qui bloque le transport du glucose, comme le fait la phloridzine. On a pu démontrer l’existence d’un système perméasique spécifique des amino-acides diaminés (cystine, lysine, arginine, orthinine), d’un système commun pour le glycocolle, la proline et l’hydroxyproline.Dans les cellules tubulaires rénales, des systèmes analogues ont été décrits.D’autres études, portant sur des cellules tumorales, ont montré que les mécanismes de transport sont d’autant moins actifs que la chaîne latérale des amino-acides est plus grande. Ceux qui possèdent un groupement attirant les électrons (méthionine, ornithine, hydroxyproline) sont les plus activement concentrés. L’action des hormones sur ces mécanismes a pu être étudiée grâce aux amino-acides non métabolisables: l’insuline augmente ainsi l’incorporation dans le muscle de l’acide 見-amino-isobutyrique.Incorporation dans les protéinesSeule la schématisation brève des mécanismes complexes de la biosynthèse protéique peut être décrite ici.La synthèse des protéines est obtenue en reliant les acides aminés entre eux par liaison peptidique. Dans le cytoplasme cellulaire est d’abord effectuée une activation des amino-acides. Elle utilise de l’énergie (ATP) et des enzymes dites amino-acyl + ARN synthétases. Elles sont ainsi nommées car elles permettent, de façon spécifique pour chaque sorte d’acide aminé, la liaison de celui-ci avec la molécule vectrice qui lui est propre, à savoir un ARN de transfert ou tARN adéquat. L’amino-acyl + ARN ainsi réalisé par l’union spécifique AA = tARN sera incorporé par un ribosome du cytoplasme. Dans cette particule, il sera utilisé pour la traduction de l’information génétique provenant du noyau cellulaire. La molécule porteuse de cette information est appelée ARN messager ou mARN. Elle représente un transcript moléculaire codé sur l’un des gènes que contient le noyau. La lecture de l’ARN messager que réalise le ribosome détermine l’assemblage séquentiel des acides aminés en polypeptide, car leur introduction consécutive dans le ribosome traduit la succession des unités codantes (codons) du messager. De ce fait, le polypeptide produit exprime l’information génétique détenue par le messager parce que la séquence d’amino-acides de l’un est homologue de la séquence nucléotidique de l’autre.Rôle dans la néoglucogenèse et la cétogenèseLes copules carbonées des amino-acides gluco-formateurs rejoignent le métabolisme glucidique et peuvent conduire au glucose puis au glycogène: cette formation de glycogène à partir des amino-acides entre dans le cadre de la néoglucogenèse qui est sous la dépendance des hormones gluco-corticostéroïdes.Un second groupe d’acides aminés comprenant leucine, isoleucine, phénylalanine, tyrosine est dit cétogène, car leur métabolisme rejoint celui des corps cétoniques, dont celui des acides gras. Physiologiquement, seule la leucine se révèle cétogène.
À ce «point isoélectrique», l’amino-acide ne migre pas en électrophorèse et sa solubilité est minimale.Absorption ultravioletteLes amino-acides n’absorbent pas les rayonnements dans la partie visible du spectre, mais possèdent un pouvoir d’absorption considérable avant 230 nm. De plus, certains amino-acides absorbent entre 250 et 300 nm, grâce à la présence, dans leur radical R, de chromophores spéciaux: indole pour le tryptophane, benzène pour la phénylalanine et la tyrosine, pont disulfure pour la cystine.Stéréo-isomérieTous les acides aminés naturels, sauf le glycocolle, possèdent un carbone asymétrique. C’est ce carbone qui porte la fonction amine, la fonction carboxylique, un atome d’hydrogène et le radical R. Tous, sauf le glycocolle, sont donc actifs sur la lumière polarisée. L’alanine se présente ainsi sous deux formes, L ou D-alanine, qui sont deux isomères optiques ou énantiomorphes. La forme D possède une structure spatiale analogue à celle du D-glycéraldéhyde qui est le corps de référence, tandis que la forme L correspond au L-glycéraldéhyde. La terminologie D-L ne correspond pas au pouvoir rotatoire de la substance qui doit être indiqué par un signe + ou 漣 suivant son caractère dextrogyre ou lévogyre: exemple L (+) isoleucine, L (face=F0019 漣) leucine.Lorsque l’acide aminé possède deux carbones asymétriques (ex.: thréonine, isoleucine, hydroxylysine, hydroxyproline), on retrouve quatre isomères: l’isomère naturel porte simplement le préfixe L (ex.: L-isoleucine), l’énantiomorphe sera la D-isoleucine; les deux autres isomères seront la D et la L-allo-isoleucine.Tous les amino-acides naturels sont de la série L, quelques amino-acides de la série D ont été retrouvés dans les micro-organismes et dans des protéines de mammifères non soumises à renouvellement.Propriétés chimiquesLes propriétés chimiques sont dues à l’existence d’un groupe carboxyle, d’un groupe amine, à la coexistence de ces deux groupes et à la structure du radical R.Réactions du groupe carboxyleDeux réactions sont particulièrement importantes: l’estérification et la décarboxylation.L’estérification des amino-acides permet leur transformation en dérivés volatils au cours de l’analyse par chromatographie en phase gazeuse. Les esters n -butyliques sont les plus utilisés. Cependant, l’insolubilité de certains amino-acides (cystine, lysine, histidine) dans l’alcool n -butylique conduit à réaliser l’estérification avec du méthanol absolu saturé par de l’acide chlorhydrique anhydre, dans lequel tous les acides aminés sont solubles. Ensuite, on convertit quantitativement les dérivés obtenus en esters n -butyliques par inter-estérification.Les esters des amino-acides sont réduits en amino-alcools par l’hydrure double de lithium et de bore; cette réaction a été utilisée pour la détermination des résidus C-terminaux des peptides et des protéines.La décarboxylation des amino-acides est aisément obtenue par chauffage dans un solvant inerte; elle conduit à la formation d’amines, dont certaines jouent un rôle biologique essentiel (histamine, tyramine).Réactions du groupe amineDe très nombreuses réactions utilisant la réactivité de la fonction amine ont été décrites: elles sont particulièrement utilisées pour la détermination des groupements NH2 terminaux des peptides ou protéines.La détermination des NH2 terminaux des protéines utilise une N-arylation ou l’action de l’isothiocyanate de phényle.a ) Le dinitro-2, 4 fluorobenzène se condense à froid; en milieu alcalin, avec la fonction amine des amino-acides pour donner un dérivé dinitrophénylé ou dérivé DNP (réaction 2); elle est peu utilisée.b ) L’isothiocyanate de phényle, en milieu basique, se combine à la fonction NH2 des amino-acides (réaction 3).En milieu acide, le produit formé se condense en phénylthiohydantoïne ou PTH amino-acide thiohydantoïne (formule 4).Cette technique d’Edmann permet de préciser la nature du premier amino-acide d’une protéine. Seul l’amino-acide N terminal est détaché, laissant intact le reste du peptide qui pourra donc être utilisé pour une nouvelle analyse. Cette méthode dite récurrente est à la base de la technique automatique de séquençage des peptides, méthode d’Edman utilisant un séquenceur.c ) D’autres réactifs (chlorure de dansyl, chlorure de dabsyl) sont utilisés pour l’analyse de l’amino-acide N terminal des protéines; les produits obtenus étant fluorescents, la méthode est très sensible.Réactions du carboxyle et de l’amine en size=4見Les amino-acides peuvent chélater l’ion cuivrique pour former des complexes comportant une ou deux molécules d’amino-acides par atome de cuivre; en même temps apparaît une coloration bleu intense utilisable pour les dosages colorimétriques.Les amino-acides en solution aqueuse bouillante réagissent avec la ninhydrine (hydrate de tricétohydrindène) pour donner, à pH acide, une coloration pourpre ou pourpre de Ruhemann, sauf avec la proline et l’hydroxy-proline qui fournissent une coloration jaune. L’amino-acide est décomposé en gaz carbonique ammoniac et aldéhyde inférieur R 漣CHO. Cette coloration est utilisée dans les dosages des amino-acides après chromatographie sur colonne.Une très importante propriété des deux fonctions est la formation de liaison amide; lorsque celle-ci s’effectue entre deux amino-acides, on parle de liaison peptidique ou liaison 漣CO 漣NH. Elle est peptidoïde si la liaison s’effectue entre un acide- 見-aminé et un amino-acide non 見-aminé; pseudo-peptidique lorsqu’elle se produit entre un acide 見-aminé et un corps quelconque.Réaction du radical RChaque amino-acide possède une réactivité propre due à son radical R, déterminant ainsi les différents tests colorés spécifiques pour l’identification des divers amino-acides ou certaines propriétés particulières comme l’halogénation de la tyrosine et la formation du pont disulfure entre deux molécules de cystéine.Analyse des amino-acidesL’analyse des mélanges d’amino-acides fournis par l’hydrolyse des protéines ou peptides est réalisée à l’aide de techniques permettant la séparation et le dosage soit d’un seul acide aminé, soit de tous les amino-acides.DosageL’oxydation par l’acide périodique permet de doser spécifiquement les amino-acides hydroxylés (sérine, thréonine, hydroxylysine) par dosage de l’aldéhyde formé. Des réactions colorées permettent de réaliser des dosages colorimétriques de certains amino-acides (arginine, histidine, tyrosine, tryptophanne). Des méthodes enzymatiques permettent de réaliser des dosages spécifiques de plusieurs acides aminés (acide glutamique, alanine, arginine, etc.). La plupart des amino-acides étant des facteurs de croissance pour certains micro-organismes, il est presque toujours possible de doser ces amino-acides par leur action sur le développement microbien qui, dans certaines limites, est proportionnel à la concentration en amino-acide du milieu de culture (méthode de Guthrie).L’addition d’un amino-acide radioactif à un mélange d’amino-acides permet de calculer le rendement d’opérations destinées à purifier l’amino-acide choisi: après dosage de l’amino-acide purifié, on peut calculer simplement la concentration préexistante de l’amino-acide non radioactif (technique de dilution isotopique).SéparationC’est la technique la plus utilisée. La méthode qualitative est la chromatographie sur papier ou support solide, uni- ou bidimensionnelle, avec repérage des taches par réactions colorées. On obtient des résultats quantitatifs avec le fractionnement par chromatographie sur résines cationiques suivi de dosages colorimétriques des éluats, par chromatographie en phase gazeuse après transformation des amino-acides en esters n- butyliques par chromatographie sur support hydrophobe des acides aminés préalablement transformé en PTH amino-acides (fig. 2). Ces trois dernières techniques sont automatisées.Propriétés biochimiquesLes processus généraux de dégradation et de synthèse, intéressant la fonction 見-amino-acide proprement dite, peuvent être séparés en désamination, décarboxylation, transamination. Au cours du métabolisme, les groupements NH2 libérés seront utilisés dans l’uréogenèse et l’ammoniogenèse. La variabilité du radical R des amino-acides entraîne par ailleurs une diversité des réactions propres à chaque amino-acide (cf. EXCRÉTION, physiologie animale).Désamination oxydativeLa désamination des acides- 見-aminés est pratiquement toujours effectuée par oxydation avec formation d’acide 見-cétonique et d’ammoniac suivant la réaction simplifiée 5.La nécessité d’un apport d’oxygène a été démontrée: un atome d’oxygène est consommé par molécule d’amino-acide oxydé, et la quantité d’ammoniac libérée est équi-moléculaire de celle de l’acide- 見-cétonique formé.La vitesse de désamination est curieusement plus grande avec les amino-acides de la série D (non naturelle) qu’avec ceux de la série L (naturelle).On a isolé, dans le foie et le rein de mammifères, quatre amino-acide-oxydases principales:La D-amino-acide-oxydase: la première isolée et la plus abondante; son groupement prosthétique est la flavine-adénine-dinucléotide (FAD). La spécificité de l’enzyme varie suivant l’origine (espèce, organe); presque tous les D-amino-acides sont désaminés, mais les L-amino-acides le sont également quoique à un taux très faible. Cet enzyme peut cependant être utilisé pour détruire électivement les isomères D d’un amino-acide sous forme racémique.La L-amino-acide-oxydase rénale ou hépatique possède comme groupement prosthétique la flavine mono-nucléotide (FMN). Elle désamine les L-acides mono-amines mono-carboxyliques à l’exception des amino-acides hydroxylés. Elle est très peu active in vitro. L’enzyme isolé du venin de serpent se révèle très actif et son groupement prosthétique est le FAD.La glycocolle-oxydase: sa structure est proche de celle de la D-amino-acide-oxydase, et l’identité de ces deux enzymes est discutée. Elle agit sur le glycocolle ou le N-méthylglycocolle, mais à pH élevé et à forte concentration de substrat, ce qui pose le problème de son rôle biologique.La L-glutamique déshydrogénase (obtenue à l’état cristallisé): c’est une protéine de poids moléculaire 250 000 formée de quatre sous-unités reliées entre elles par quatre atomes de zinc. Son coenzyme est le NAD (nicotinamide-adénine-dinucléotide) ou le NADP.Sa distribution tissulaire est très large. Elle assure la désamination de l’acide-L-glutamique en acide- 見-cétoglutarique (réaction 6).Sa spécificité est étroite et son importance métabolique considérable. Dans certains cas, la désamination peut être le fait de réactions spécifiques non oxydatives:– départ de SH2 avec la cystéine désulfhydrase;– départ de H2O avec la thréonine-désaminase;– désamination désaturante de l’histidine.DécarboxylationC’est un processus général des tissus animaux et végétaux et des micro-organismes. Elle s’effectue suivant la réaction 7.Plusieurs des enzymes responsables ont été cristallisés; ils admettent le pyridoxal-5 phosphate pour coenzyme (tabl. 2).L’aromatique L amino-acide-décarboxylase (tabl. 3) permet la décarboxylation de la 3,4-dihydroxy-phénylalanine (DOPA) en dopamine, de l’hydroxy-5 tryptophane en hydroxy-5 tryptamine (ou sérotonine), de la phénylalanine en phényléthylamine, de la tyrosine en tyramine, du tryptophane en tryptamine, de l’histidine en histamine. La plupart de ces substances jouent un grand rôle biologique: histamine dans le choc anaphylactique, dopamine comme précurseur de la noradrénaline, sérotonine dans le métabolisme cérébral.D’autres activités décarboxylasiques ont été retrouvées: acide cystéique-décarboxylase dans le foie, la rate, le cerveau, transformant l’acide cystéique en taurine; acide glutamique-décarboxylase dans le cerveau, transformant l’acide glutamique en acide 塚-amino-butyrique (ou GABA), ornithine décarboxylase transformant l’ornithine en putrescine précurseur des polyamines.Des décarboxylases bactériennes attaquent les acides aminés basiques libérant agmatine, putrescine, cadavérine à partir de l’arginine, ornithine, lysine: ces substances toxiques que l’on désignait sous le terme de ptomaïnes se forment lors de putréfactions intestinales excessives.Les amines formées par décarboxylation sont dégradées par un processus de désamination oxydative grâce à une mono-amine-oxydase (MAO) ou une diaminoxydase avec formation d’ammoniac et d’aldéhyde possédant un carbone de moins que l’amino-acide initial. La MAO est très largement répandue dans l’organisme: elle intervient dans le métabolisme cérébral des catécholamines et de la sérotonine. La diaminoxydase ou histaminase agit sur les diamines ou les amines possédant un second groupe basique (histamine, agmatine) et sur les polyamines; elle est inhibée par les mono-amines.TransaminationC’est l’ensemble des mécanismes par lesquels un amino-acide peut transférer sa fonction amine à un acide 見-cétonique. Les enzymes responsables portent le nom de transaminases ou aminotransférases; leur coenzyme est là encore le phosphate de pyridoxal qui passe intermédiairement par l’état de phosphate de pyridoxamine, selon le mécanisme que schématise le tableau 4.Les voies qui paraissent les plus importantes impliquent la présence du système acide glutamique-acide 見-cétoglutarique; les enzymes responsables ont été isolés et purifiés:acide glutamique + acide pyruvique燎 acide 見-cétoglutarique + alanine ;acide glutamique + acide oxalo-acétique燎 acide 見-cétoglutarique + acide aspartique.La réaction acide aspartique + acide pyruvique 燎 acide oxalo-acétique + alanine ne serait que le résultat d’un couplage des deux réactions précédentes.D’autres amino-acides peuvent aussi subir ces transaminations: les plus actifs sont la valine, la leucine et l’isoleucine; les moins actifs l’histidine et la lysine.D’autres types de transaminations ont été plus récemment décrits:燎 Transamination en 諸:ac. 塚-aminobutyrique + ac. 見-cétoglutarique 燎 semi-aldéhyde succinique + ac. L-glutamique;L-ornithine + acide 見-cétonique燎 semi-aldéhyde L-glutamique + ac. 見-aminé.燎 Transamination à partir d’amides (glutamine ou asparagine):L-glutamine + acide 見-cétonique燎 ac. 見-cétoglutaramique + ac. 見-aminé.L’acide 見-cétoglutaramique est scindé en acide 見-cétoglutarique et ammoniac par une 諸-amidase.Il existe un contraste entre la faible activité des L-amino-acides oxydases (à l’exception de la L-glutamique déshydrogénase) et l’importance des mécanismes de transamination: ce fait plaide en faveur de la prédominance de ceux-ci dans les synthèses et les dégradations des amino-acides. Pour Braunstein, les amino-acides subissent, pour la plupart, une désamination indirecte grâce à la transamination: le groupement NH2 de l’amino-acide est donc d’abord transféré sur l’acide 見-cétoglutarique, et l’acide glutamique ainsi formé est ensuite désaminé par sa déshydrogénase spécifique. Cette conception, vérifiée grâce à l’utilisation d’azote lourd, permet d’établir une classification des amino-acides en deux groupes. Le premier groupe comprend les amino-acides qui ne peuvent être synthétisés dans l’organisme que par transamination ou amination réductrice des acides 見-cétoniques ou des acides hydroxylés correspondants. Ceux-ci n’étant pas des produits normaux du métabolisme intermédiaire des glucides ou des lipides, les réactions se limitent à des échanges du groupement NH2 sans qu’il y ait vraiment de synthèse de novo de ces amino-acides: il en résulte que ceux-ci sont indispensables, c’est-à-dire qu’ils doivent obligatoirement être présents dans la ration alimentaire (tryptophane, phénylalanine, méthionine, valine, leucine, isoleucine).Le second groupe est formé par les amino-acides dont le métabolisme particulier est incompatible avec une synthèse, à partir des acides cétoniques ou hydroxylés correspondants: autrement dit, leur transamination et leur désamination ne sont pas réversibles; suivant les cas, ou bien ils doivent être apportés par l’alimentation et figurent alors dans les amino-acides indispensables (exemples: lysine et thréonine), ou bien leur synthèse s’opérera dans l’organisme, à partir d’autres acides aminés sans échange de NH2, par des réactions de conversion (exemples: glycocolle, cystéine).Propriétés biologiquesPénétration des amino-acides dans la celluleLa constitution par les cellules d’un pool d’amino-acides à fortes concentrations est en rapport avec leur métabolisme, et notamment avec leurs propriétés de synthèse protéique. Les amino-acides pénètrent dans les cellules par simple diffusion, mais aussi grâce à un processus actif qui permet leur accumulation dans la cellule à l’encontre du gradient de concentration. Ce dernier mécanisme consomme de l’énergie; il est plus actif vis-à-vis des formes L naturelles que vis-à-vis des formes D. Les études cinétiques ont montré l’existence de relations de type michaélien entre la concentration intérieure et extérieure de l’amino-acide ainsi que l’existence de phénomènes de compétition entre divers amino-acides.Dans les cellules de la muqueuse intestinale . Les poisons cellulaires (cyanure) ou les découplants des oxydations phosphorylantes (dinitro-2, phénol) sont inhibiteurs, ce qui confirme les besoins énergétiques du système actif. On a également démontré l’importance du phosphate de pyridoxal, grâce à l’inhibition provoquée par ses analogues structuraux. Le transport des amino-acides est indépendant de celui du glucose, comme en témoignent l’absence de compétition entre les deux systèmes et l’absence d’inhibition par un produit qui bloque le transport du glucose, comme le fait la phloridzine. On a pu démontrer l’existence d’un système perméasique spécifique des amino-acides diaminés (cystine, lysine, arginine, orthinine), d’un système commun pour le glycocolle, la proline et l’hydroxyproline.Dans les cellules tubulaires rénales, des systèmes analogues ont été décrits.D’autres études, portant sur des cellules tumorales, ont montré que les mécanismes de transport sont d’autant moins actifs que la chaîne latérale des amino-acides est plus grande. Ceux qui possèdent un groupement attirant les électrons (méthionine, ornithine, hydroxyproline) sont les plus activement concentrés. L’action des hormones sur ces mécanismes a pu être étudiée grâce aux amino-acides non métabolisables: l’insuline augmente ainsi l’incorporation dans le muscle de l’acide 見-amino-isobutyrique.Incorporation dans les protéinesSeule la schématisation brève des mécanismes complexes de la biosynthèse protéique peut être décrite ici.La synthèse des protéines est obtenue en reliant les acides aminés entre eux par liaison peptidique. Dans le cytoplasme cellulaire est d’abord effectuée une activation des amino-acides. Elle utilise de l’énergie (ATP) et des enzymes dites amino-acyl + ARN synthétases. Elles sont ainsi nommées car elles permettent, de façon spécifique pour chaque sorte d’acide aminé, la liaison de celui-ci avec la molécule vectrice qui lui est propre, à savoir un ARN de transfert ou tARN adéquat. L’amino-acyl + ARN ainsi réalisé par l’union spécifique AA = tARN sera incorporé par un ribosome du cytoplasme. Dans cette particule, il sera utilisé pour la traduction de l’information génétique provenant du noyau cellulaire. La molécule porteuse de cette information est appelée ARN messager ou mARN. Elle représente un transcript moléculaire codé sur l’un des gènes que contient le noyau. La lecture de l’ARN messager que réalise le ribosome détermine l’assemblage séquentiel des acides aminés en polypeptide, car leur introduction consécutive dans le ribosome traduit la succession des unités codantes (codons) du messager. De ce fait, le polypeptide produit exprime l’information génétique détenue par le messager parce que la séquence d’amino-acides de l’un est homologue de la séquence nucléotidique de l’autre.Rôle dans la néoglucogenèse et la cétogenèseLes copules carbonées des amino-acides gluco-formateurs rejoignent le métabolisme glucidique et peuvent conduire au glucose puis au glycogène: cette formation de glycogène à partir des amino-acides entre dans le cadre de la néoglucogenèse qui est sous la dépendance des hormones gluco-corticostéroïdes.Un second groupe d’acides aminés comprenant leucine, isoleucine, phénylalanine, tyrosine est dit cétogène, car leur métabolisme rejoint celui des corps cétoniques, dont celui des acides gras. Physiologiquement, seule la leucine se révèle cétogène.
Encyclopédie Universelle. 2012.
